|
GEMTABINE là một chế phẩm bột đông khô để pha tiêm chứa thành phần chính là gemcitabin – một nucleoside pyrimidin tổng hợp, được xếp vào nhóm thuốc kháng chuyển hóa, dùng trong hóa trị liệu tế bào ung thư.
Gemcitabin có tên chung là 2’-deoxy-2’, 2’-difluoro-cytidin monohydroclorid (đồng phân b), với công thức cấu tạo như sau:
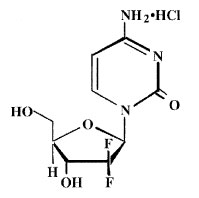
Gemcitabin được tổng hợp lần đầu tiên trong pḥng thí nghiệm tại nhà máy Eli Lilly vào đầu những năm 1980. Ban đầu nó được dự định dùng như một loại thuốc kháng virus, nhưng thử nghiệm tiền lâm sàng cho thấy nó đă giết chết tế bào bạch cầu trong ống nghiệm.
Chế phẩm GEMTABINE được bào chế dưới dạng bột đông khô đóng bánh màu trắng đến trắng nhạt đựng trong lọ không màu, dùng để pha tiêm.
Thành phần của 1 lọ thuốc chứa :
Gemcitabin HCl 1,14 g
(Tương đương 1 g Gemcitabin)
Tá dược: malnitol, natri acetat, natri hydroxid, acid hydrocloric.
CƠ CHẾ TÁC ĐỘNG – DƯỢC LỰC HỌC
Gemcitabin ức chế giai đoạn phát triển đặc biệt của tế bào, chủ yếu giết chết các tế bào đang trong quá tŕnh tổng hợp DNA (giai đoạn-S) và cũng ngăn chặn sự phát triển của tế bào qua đường biên G1/giai đoạn-S.
Gemcitabin là một tiền chất và bị chuyển hóa trong nội bào thành các nucleoside có hoạt tính diphosphate (dFdCDP) và triphosphate (dFdCTP). Các tác dụng gây độc tế bào của Gemcitabin thông qua dFdCDP – chất trợ lực giúp dFdCTP sát nhập vào DNA, kết quả là ức chế sự tổng hợp DNA và tạo ra quá tŕnh chết tế bào.
Một cơ chế khác của gemcitabin là ức chế enzym ribonucleotid reductase (RNR). Các dẫn chất diphosphate liên kết với RNR ở trạng thái hoạt động và ức chế không hồi phục các enzym này. Một khi RNR bị ức chế, các tế bào không thể sản xuất các deoxyribonucleotid cần thiết để tái tạo và sửa chữa DNA, và giảm gây độc tế bào.
DƯỢC ĐỘNG HỌC
Hấp thu và phân bố
Thể tích phân bố của Gemcitabin bị ảnh hưởng bởi thời gian tiêm truyền, tuổi và giới tính. Thể tích phân bố tăng lên khi truyền thuốc trong thời gian dài. Thể tích phân bố của Gemcitabin là 50 L/m2 sau khi truyền trong thời gian < 70 phút chỉ ra rằng Gemcitabin sau khi truyền trong thời gian ngắn không phân bố rộng răi vào trong các mô.
Chưa biết thuốc có qua hàng rào máu năo hay không.
Chuyển hóa và thải trừ
Gemcitabin bị chuyển hóa trong nội bào thành các phần có hoạt tính và nhanh chóng đi vào máu, gan, thận và các mô khác. Trong huyết tương, nó bị chuyển hóa thành chất chuyển hóa không có hoạt tính dạng difluorouridin.
Thời gian bán thải khi truyền thuốc trong thời gian ngắn là 42 đến 94 phút và khi truyền trong thời gian dài là 245 đến 638 phút, phụ thuộc vào tuổi và giới tính, tương ứng với sự tăng thể tích phân bố khi truyền thuốc trong thời gian dài.
Chất chuyển hóa có hoạt tính - Gemcitabin triphosphat- có thể tách được từ các tế bào đơn nhân trong máu ngoại biên. Thời gian bán thải của pha cuối cùng của Gemcitabin triphosphat từ các tế bào đơn nhân trong khoảng 1,7 đến 19,4 giờ.
Nồng độ cực đại trong huyết tương của chất chuyển hóa không có hoạt tính đạt được trong ṿng 30 phút sau khi ngừng tiêm truyền và nó được bài tiết trong nước tiểu mà không trải qua thêm một sự chuyển hóa sinh học nào nữa. Chất chuyển hóa này không tích lũy với liều sử dụng hàng tuần, nhưng sự thải trừ phụ thuộc vào sức bài tiết của thận, và có thể tích lũy khi bị suy giảm chức năng thận.
CHỈ ĐỊNH
Ung thư phổi không phải tế bào nhỏ:
Gemcitabin được chỉ định phối hợp với Cisplatin trong chế độ trị liệu đầu tiên cho các bệnh nhân ung thư phổi không phải tế bào nhỏ không thể phẫu thuật, tiến triển tại chỗ (giai đoạn IIIA hay IIIB) hoặc ung thư di căn (giai đoạn IV).
Ung thư tuyến tụy:
Gemcitabin được chỉ định trong chế độ trị liệu đầu tiên cho các bệnh nhân ung thư tuyến tụy tiến triển tại chỗ (không thể cắt bỏ, ở giai đoạn II hoặc III) hay ung thư di căn (giai đoạn IV)
Ung thư vú:
Gemcitabin được chỉ định phối hợp với Paclitaxel trong chế độ trị liệu đầu tiên cho các bệnh nhân ung thư vú ác tính sau khi thất bại với hóa trị liệu có sử dụng Anthracyclin, trừ khi các Anthracyclin bị chống chỉ định.
Ung thư bàng quang.
LIỀU LƯỢNG VÀ CÁCH DÙNG
Ung thư phổi không phải tế bào nhỏ:
* Đơn trị liệu:
Người lớn: Gemcitabin HCl cần được sử dụng bằng cách tiêm truyền tĩnh mạch với liều 1000 mg/m2 trong 30 phút, mỗi tuần 1 lần trong 3 tuần liên tiếp (hoặc đến khi độc tính đ̣i hỏi phải giảm liều hay ngừng sử dụng ), sau đó nghỉ 1 tuần. Đợt điều trị tiếp theo bao gồm mỗi tuần một lần trong 3 tuần liên tiếp của chu kỳ 4 tuần.
*Điều trị phối hợp:
Người lớn: Hai phác đồ trị liệu đă được nghiên cứu kỹ và chưa xác định được phác đồ tối ưu. Với phác đồ điều trị trong 4 tuần, Gemcitabin HCl được tiêm truyền tĩnh mạch liều 1000 mg/m2 trong 30 phút vào các ngày 1, 8 và 15 trong mỗi chu kỳ 28 ngày. Cisplatin cần được tiêm tĩnh mạch liều 100 mg/m2 vào ngày 1 sau khi truyền Gemcitabin HCl. Với phác đồ điều trị trong 3 tuần, Gemcitabin HCl cần được tiêm truyền tĩnh mạch liều 1250 mg/m2 trong 30 phút vào các ngày 1 và 8 trong mỗi chu kỳ 21 ngày. Cisplatin với liều 100 mg/m2 được tiêm tĩnh mạch sau khi truyền Gemcitabin HCl vào ngày 1.
Ung thư tuyến tụy:
Người lớn: Gemcitabin HCl được tiêm truyền tĩnh mạch liều 1000 mg/m2 trong 30 phút, mỗi tuần 1 lần trong 7 tuần (hoặc đến khi độc tính đ̣i hỏi phải giảm liều hay ngừng sử dụng), sau đó nghỉ 1 tuần. Đợt điều trị tiếp theo bao gồm 3 tuần truyền thuốc liên tiếp, mỗi tuần 1 lần của chu kỳ 4 tuần.
Ung thư bàng quang:
Người lớn: Khi phối hợp với Cisplatin, Gemcitabin HCl được tiêm truyền tĩnh mạch liều 1000 mg/m2 trong 30 phút vào các ngày 1, 8 và 15 trong mỗi chu kỳ 28 ngày, sau đó nghỉ 1 tuần. Trong chu kỳ 28 ngày, Cisplatin cần được tiêm tĩnh mạch liều 70 mg/m2 vào ngày 1 sau khi truyền Gemcitabin HCl hoặc vào ngày 2. Chu kỳ điều trị 4 tuần có thể được nhắc lại. Trước khi tiến hành hóa trị liệu, việc giảm liều hay tŕ hoăn dùng thuốc cần được cân nhắc kỹ lưỡng dựa trên mức độ các tác dụng phụ của thuốc đối với bệnh nhân. Theo các kết quả thử lâm sàng, điều trị phối hợp với Cisplatin 100 mg/m2 có thể làm giảm đáng kể sự suy tủy.
Ung thư vú:
Người lớn: Gemcitabine HCl được tiêm truyền tĩnh mạch liều 1250 mg/m2 trong 30 phút vào các ngày 1 và 8 trong mỗi chu kỳ 21 ngày. Paclitaxel cần được tiêm truyền tĩnh mạch liều 175 mg/m2 trong 3 giờ vào ngày 1 trước khi truyền Gemcitabin HCl. Bệnh nhân cần được kiểm tra công thức máu đầy đủ trước mỗi lần dùng thuốc. Trước mỗi đợt điều trị, bệnh nhân phải chắc chắn có số lượng bạch cầu hạt là 1500 x 1.000.000/L và số lượng tiểu cầu = 100.000 x 1.000.000/L
Bệnh nhân sử dụng Gemcitabin HCl cần được theo dơi chặt chẽ công thức máu đầy đủ trước mỗi liều dùng của thuốc, bao gồm số lượng hồng cầu, bạch cầu các loại, tiểu cầu…. Nếu phát hiện suy tủy, việc điều trị cần được thay đổi hoặc tạm ngừng theo bảng hướng dẫn sau:
|
Số lượng bạch cầu hạt (x 1.000.000/L) |
Số lượng tiểu cầu (x 1.000.000/L) |
% liều dùng đầy đủ |
| > 1000 và |
> 100.000 |
100 |
| 500 - 1000 hoặc |
50.000 – 100.000 |
75 |
| < 500 hoặc |
< 50.000 |
Ngừng |
Các xét nghiệm chức năng gan và chức năng thận bao gồm transaminase và creatinin huyết thanh cần được tiến hành trước khi bắt đầu điều trị và định kỳ sau đó. Gemcitabin HCl phải được sử dụng thận trọng ở các bệnh nhân có bằng chứng suy gan hoặc suy thận đáng kể v́ chưa có đủ thông tin từ các nghiên cứu lâm sàng cho phép xác định rơ ràng liều khuyến cáo cho nhóm bệnh nhân này.
Lưu ư khi sử dụng:
- Chất pha loăng dùng để hoàn nguyên thuốc tiêm Gemcitabin HCl là dung dịch tiêm Natri clorid 0,9% không có chất bảo quản. Do khả năng ḥa tan của Gemcitabin HCl, nồng độ tối đa của Gemcitabin HCl sau khi hoàn nguyên là 40 mg/ml. Tránh hoàn nguyên thuốc ở nồng độ trên 40 mg/ml v́ có thể thuốc không được ḥa tan hoàn toàn.
- Để hoàn nguyên thuốc, thêm 5 ml dung dịch tiêm Natri clorid 0,9% vào lọ 200 mg hoặc 25 ml dung dịch tiêm Natri clorid 0,9% vào lọ 1 g Gemcitabin HCl. Lắc để ḥa tan thuốc. Nồng độ Gemcitabin của mỗi dung dịch sau khi pha loăng là 38 mg/ml, có tính đến thể tích chiếm chỗ của bột thuốc đông khô. (0,26 ml đối với lọ 200 mg hay 1,3 ml đối với lọ 1 g). Tổng thể tích thuốc sau khi hoàn nguyên lần lượt là 5,26 ml và 26,3 ml. Rút toàn bộ lượng thuốc trong lọ ra sẽ thu được lần lượt 200 mg và 1 g Gemcitabin HCl. Lượng thuốc thích hợp có thể được sử dụng bằng dung dịch hoàn nguyên nói trên hoặc tiếp tục được pha loăng với dung dịch tiêm Natri clorid 0,9% đến nồng độ thấp tới 0,1 mg/ml. Dung dịch Gemcitabin HCl sau khi hoàn nguyên phải trong, không màu và ổn định trong 24 giờ ở nhiệt độ 200C đến 250C. Bỏ đi phần thuốc không sử dụng. Không nên giữ lạnh dung dịch Gemcitabin HCl sau khi hoàn nguyên v́ thuốc có thể bị kết tinh.
- Cẩn thận khi cầm và pha các dung dịch Gemcitabin HCl. Việc sử dụng găng tay là bắt buộc. Nếu dung dịch Gemcitabin HCl bắn lên da hoặc niêm mạc, rửa sạch da ngay và hoàn toàn với nước và xà pḥng hoặc rửa nhẹ nhàng niêm mạc với nhiều nước. Mặc dù kích ứng da cấp đă được báo cáo trong các nghiên cứu trên động vật, 2 hoặc 3 thỏ thí nghiệm có biểu hiện nhiễm độc toàn thân do dùng thuốc (chết, giảm hoạt động, chảy mủ ở mũi, thở nông) do hấp thu qua da.
SỬ DỤNG CHO NGƯỜI GIÀ
Độ thanh thải của Gemcitabin bị ảnh hưởng của tuổi. Tuy nhiên, không có bằng chứng chứng minh rằng việc điều chỉnh liều ở người trên 65 tuổi là cần thiết, và nói chung, tỷ lệ các phản ứng có hại trong các tài liệu nghiên cứu về tính an toàn của thuốc ở 979 bệnh nhân là như nhau ở các bệnh nhân trên và dưới 65 tuổi. Giảm bạch cầu độ ¾ hay gặp hơn ở người già. Trong một thử nghiệm lâm sàng có tính ngẫu nhiên sử dụng Gemcitabin phối hợp với Carboplatin cho các bệnh nhân ung thư buồng trứng tái phát, 125 bệnh nhân < 65 tuổi và 50 bệnh nhân > 65 tuổi được điều trị với Gemcitabin cộng thêm Carboplatin: Các tác dụng tương tự đă được quan sát thấy ở cả nhóm bệnh nhân già và nhóm bệnh nhân trẻ hơn. Nói chung, không có sự khác nhau đáng kể về độc tính của Gemcitabin dùng kèm Carboplatin dựa trên tuổi tác.
SỬ DỤNG CHO TRẺ EM
Tính hiệu quả của Gemcitabin trên bệnh nhân nhi chưa được thiết lập. Gemcitabin được đánh giá trong một thử nghiệm pha 1 trên các bệnh nhân nhi bị bệnh bạch cầu măn tính và được xác định là dung nạp tối đa ở liều 10 mg/m2/phút trong 360 phút, 3 lần mỗi tuần, sau đó nghỉ 1 tuần. Gemcitabin cũng được đánh giá trong một thử nghiệm pha 2 ở các bệnh nhân nhi bị bệnh bạch cầu nguyên bào lympho cấp tái phát (22 bệnh nhân) và bệnh bạch cầu tủy bào cấp (10 bệnh nhân) sử dụng liều 10 mg/m2/phút trong 360 phút, 3 lần mỗi tuần, sau đó nghỉ 1 tuần. Độc tính quan sát được gồm: suy tủy, sốt giảm bạch cầu trung tính, tăng các trasaminase huyết thanh, buồn nôn, và phát ban/tróc vảy, các hiện tượng này tương tự như đă được báo cáo ở người lớn. Không có các tác dụng lâm sàng có ư nghĩa được quan sát thấy trong thử nghiệm pha 2 này.
SỬ DỤNG THUỐC Ở PHỤ NỮ CÓ THAI VÀ CHO CON BÚ
Tính an toàn của sản phẩm này khi sử dụng cho phụ nữ có thai chưa được xác định. Những đánh giá dựa trên các nghiên cứu ở động vật cho thấy thuốc gây độc đối với khả năng sinh sản như: gây khuyết tật ở con sinh ra hoặc gây các ảnh hưởng khác nhau lên phôi hay bào thai, lên thời gian thai nghén, hay sự phát triển của bào thai. Do đó không sử dụng Gemcitabin cho phụ nữ mang thai hay phụ nữ cho con bú v́ khả năng gây hại cho bào thai hoặc trẻ mới sinh.
CHỐNG CHỈ ĐỊNH
Bệnh nhân được biết quá mẫn cảm với thuốc này.
Bệnh nhân suy thận nặng cần tránh phối hợp với Cisplatin.
Việc sử dụng thuốc cho các bệnh nhân suy giảm chức năng gan trung b́nh đến nặng và suy giảm chức năng thận nặng (tốc độ lọc cầu thận < 30 ml/phút) chưa được nghiên cứu, do đó không sử dụng Gemcitabin HCl cho các bệnh nhân này.
Bệnh nhân suy tủy nặng.
Bệnh nhân nhiễm trùng nặng do biến chứng.
Phụ nữ có thai hoặc dự định có thai.
Phụ nữ cho con bú.
THẬN TRỌNG
Bệnh nhân suy tủy.
Bệnh nhân có tiền sử hoặc bị biến chứng viêm phổi kẽ hay xơ hóa phổi.
Bệnh nhân suy gan.
Bệnh nhân rối loạn thận.
Bệnh nhân có tiền sử nhồi máu cơ tim.
THẬN TRỌNG CHUNG
Kéo dài thời gian tiêm trên 60 phút và tăng tần suất sử dụng thuốc hơn 1 lần trong tuần cho thấy làm tăng độc tính.
Chế phẩm này chỉ được dùng tiêm tĩnh mạch. Bệnh nhân điều trị với Gemcitabin cần được theo dơi cẩn thận bởi thầy thuốc có kinh nghiệm trong việc sử dụng các thuốc hóa học trị bệnh ung thư.
Gemcitabin có thể gây suy giảm chức năng của tủy xương như gây giảm bạch cầu, giảm tiểu cầu và thiếu máu. Suy tủy thường là độc tính phụ thuộc liều. Các bệnh nhân cần được theo dơi hiện tượng suy tủy trong khi điều trị.
Gemcitabin cần được sử dụng thận trọng ở các bệnh nhân suy thận hoặc suy giảm chức năng gan v́ chưa có đầy đủ thông tin từ các nghiên cứu lâm sàng cho phép xác định liều khuyến cáo rơ ràng cho các đối tượng này. Việc sử dụng Gemcitabin cho các bệnh nhân bị bệnh gan ác tính hay có tiền sử bị bệnh gan, người nghiện rượu hay người bị xơ gan có thể làm trầm trọng thêm sự thiếu hụt chức năng gan.
Hội chứng tan huyết-urê huyết và/hoặc suy thận đă được báo cáo sau khi sử dụng một hay nhiều liều Gemcitabin. Suy thận dẫn tới tử vong hoặc yêu cầu phải thẩm tách, mặc dù đă ngừng điều trị, hiếm khi được báo cáo. Phần lớn các trường hợp suy thận dẫn tới tử vong là do hội chứng tan huyết-urê huyết.
Nhiễm độc gan nghiêm trọng bao gồm suy gan và tử vong rất hiếm khi được báo cáo ở các bệnh nhân sử dụng Gemcitabin đơn lẻ hay phối hợp với các thuốc có khả năng gây ngộ độc gan khác.
TÁC DỤNG KHÔNG MONG MUỐN
Huyết học: Trong các nghiên cứu về ung thư tuyến tụy, suy tủy là độc tính giới hạn liều của Gemcitabin, nhưng < 1% số bệnh nhân phải ngừng điều trị do thiếu máu, giảm bạch cầu trung tính hoặc giảm tiểu cầu. Truyền tế bào hồng cầu được yêu cầu ở 19% bệnh nhân. Tỷ lệ nhiễm trùng < 1%. Đốm xuất huyết hay mất máu nhẹ (xuất huyết) do mọi nguyên nhân được báo cáo ở 16% bệnh nhân; dưới 1% bệnh nhân cần phải truyền tiểu cầu. Các bệnh nhân cần được giám sát hiện tượng suy tủy trong khi điều trị với Gemcitabin và cần thay đổi liều hoặc ngừng thuốc tùy theo mức độ nhiễm độc máu
Gan: Trong các thử nghiệm lâm sàng, Gemcitabin HCl có liên quan đến sự tăng thoáng qua của một hoặc cả hai mức transaminase trong huyết thanh ở xấp xỉ 70% bệnh nhân, nhưng không có bằng chứng của sự tăng nhiễm độc gan cả khi sử dụng thuốc trong thời gian dài hơn hay khi tổng liều dùng cao hơn. Nhiễm độc gan trầm trọng, bao gồm suy gan và tử vong, rất hiếm khi được báo cáo ở các bệnh nhân sử dụng Gemcitabin đơn độc hoặc phối hợp với các thuốc khác có khả năng gây ngộ độc gan.
Đường dạ dày-ruột: Buồn nôn và nôn hay được báo cáo (69%) nhưng thường ở mức độ nhẹ đến trung b́nh. Buồn nôn và nôn nghiêm trọng xuất hiện ở < 15% bệnh nhân. Tiêu chảy được ghi nhận ở 19% và viêm dạ dày xuất hiện ở 11% bệnh nhân.
Bệnh phổi: Trong các thử nghiệm lâm sàng, khó thở (không liên quan đến các bệnh đang mắc), đă được báo cáo là có liên quan đến việc sử dụng Gemcitabin HCl. Khó thở đôi khi kèm theo co thắt phế quản. Nhiễm độc phổi đă được báo cáo khi sử dụng Gemcitabine HCl. Nguyên nhân của hiện tượng này chưa được biết rơ. Nếu tác dụng phụ này tăng lên, cần ngừng sử dụng Gemcitabine HCl. Điều trị hỗ trợ sớm có thể cải thiện được t́nh trạng này.
Thận: Trong các thử nghiệm lâm sàng, protein niệu và huyết niệu ở mức độ nhẹ được báo cáo phổ biến. Các phát hiện lâm sàng phù hợp với hội chứng tan huyết-urê huyết được báo cáo ở 6 trong số 2429 bệnh nhân (0,25%) sử dụng Gemcitabin HCl trong các thử nghiệm lâm sàng. Các bệnh nhân có hội chứng này tiến triển khi sử dụng Gemcitabin HCl, cần tiến hành ngay 2 phương pháp hỗ trợ. Chẩn đoán hội chứng tan huyết-urê huyết cần được cân nhắc nếu bệnh nhân thiếu máu ngày càng nặng với các bằng chứng như tan huyết do bệnh mao mạch, tăng bilirubin hay LDH, tăng hồng cầu, giảm tiểu cầu trầm trọng và/hoặc có bằng chứng của sự suy thận (tăng creatinin hoặc tăng BUN trong huyết thanh). Cần ngừng ngay lập tức việc điều trị với Gemcitabin HCl. Suy thận có thể không hồi phục thậm chí sau khi ngừng điều trị và có thể yêu cầu phải thẩm tách.
Dị ứng: Co thắt phế quản đă được báo cáo ở < 2% bệnh nhân. Các phản ứng phản vệ hiếm khi được ghi nhận. Gemcitabin HCl không được sử dụng cho các bệnh nhân được biết quá mẫn cảm với thuốc này.
Tim mạch: Trong các thử nghiệm lâm sàng, 2% bệnh nhân phải ngừng điều trị với Gemcitabin HCl do các ảnh hưởng trên tim mạch như nhồi máu cơ tim, tai biến mạch máu năo, loạn nhịp tim và tăng huyết áp. Phần lớn các bệnh nhân này trước đó đă có tiền sử bị bệnh tim mạch.
Các tác dụng phụ khác:
Các triệu chứng giống cúm: “Hội chứng cúm” được ghi nhận ở 19% bệnh nhân. Các triệu chứng riêng lẻ khác như sốt, suy nhược, chán ăn, đau đầu, ho, ớn lạnh và đau cơ thường được báo cáo. Sốt và suy nhược cũng được báo cáo thường xuyên như các triệu chứng đơn lẻ. Mất ngủ, viêm mũi, đổ mồ hôi và khó chịu thường xuyên được ghi nhận. Dưới 1% bệnh nhân phải ngừng điều trị do các triệu chứng giống cúm.
Nhiễm khuẩn: Nhiễm khuẩn được báo cáo ở 16% bệnh nhân. Nhiễm trùng hiếm khi được báo cáo (< 1% )
Rụng tóc: Rụng tóc, thường ít xảy ra, được báo cáo ở 15% bệnh nhân.
Phù: Phù (13%), phù ngoại biên (20%) và phù toàn thân (<1%) đă được báo cáo. Dưới 1% bệnh nhân phải ngừng thuốc do phù
Thoát mạch: Thoát mạch liên quan đến chỗ tiêm được ghi nhận ở 4% bệnh nhân. Không có báo cáo hoại tử chỗ tiêm. Gemcitabin HCl không làm giộp da.
Nhiễm độc thần kinh: Khoảng 10% bệnh nhân bị chứng dị cảm nhẹ và < 1% bị dị cảm nặng
TƯƠNG TÁC THUỐC
Xạ trị
Sử dụng đồng thời (sử dụng cùng lúc hoặc cách nhau = 7 ngày): Dựa trên các kết quả nghiên cứu tiền lâm sàng và các thử nghiệm lâm sàng, Gemcitabin có ảnh hưởng đến độ nhạy phóng xạ. Trong một thử nghiệm đơn lẻ, Gemcitabin với liều 1000 mg/m2 được sử dụng đồng thời với việc xạ trị ngực trong thời gian lên đến 6 tuần cho các bệnh nhân ung thư phổi tế bào không nhỏ, độc tính đáng kể biểu hiện ở các dạng viêm niêm mạc nặng và có khả năng đe dọa tính mạng, nhất là viêm hầu họng và viêm thành phế nang đă được quan sát thấy, đặc biệt ở các bệnh nhân bị chiếu xạ với thể tích lớn (thể tích điều trị trung b́nh 4795 cm3). Các nghiên cứu sau đó đă giả thiết rằng việc sử dụng Gemcitabine với liều thấp hơn đồng thời với chiếu xạ có thể dự báo trước độc tính, giống như ở một nghiên cứu pha 2 trên các bệnh nhân ung thư phổi tế bào không nhỏ. Điều kiện tốt nhất đối với tính an toàn của việc sử dụng Gemcitabine cùng với liều điều trị của tia xạ c̣n chưa được xác định.
Sử dụng sau (cách > 7 ngày): Các thông tin sẵn có không chỉ ra bất cứ một sự tăng độc tính nào khi sử dụng Gemcitabine ở các bệnh nhân được chiếu xạ so với bệnh nhân không chiếu xạ. Tài liệu gợi ư rằng Gemcitabin có thể bắt đầu sử dụng sau khi các ảnh hưởng cấp tính của việc xạ trị đă được giải quyết hoặc ít nhất 1 tuần sau khi xạ trị. Các tài liệu sẵn có không cho thấy bất kỳ sự tăng độc tính nào của việc xạ trị sau khi sử dụng Gemcitabin.
Các thuốc chống đông dùng đường uống (như Warfarin)
Tăng tần suất theo dơi v́ có khả năng tăng hiệu quả chống đông.
Vaccine sốt vàng
Chống chỉ định v́ có thể tăng nguy cơ tử vong v́ bị bệnh do vaccine.
Các vaccin sống đă giảm hiệu lực (trừ vaccine sốt vàng)
Không sử dụng đồng thời v́ có nguy cơ bị bệnh toàn thân, có thể tử vong, đặc biệt là ở các bệnh nhân suy giảm miễn dịch. Cần sử dụng vaccin bất hoạt (như vaccin bại liệt).
Phenytoin
Không đề nghị sử dụng đồng thời. Tăng nguy cơ co giật do giảm hấp thu Phenytoin từ dạ dày ruột. Nguy cơ tăng độc tính hoặc giảm tác dụng của Gemcitabin là do tăng chuyển hóa ở gan bởi Phenytoin.
Cyclosporin, Tacrolimus
Giảm miễn dịch quá mức kèm theo nguy cơ tăng lympho bào.
TÁC ĐỘNG CỦA THUỐC ĐẾN KHẢ NĂNG LÁI XE VÀ VẬN HÀNH MÁY MÓC
Gemcitabin đă được báo cáo là gây chứng ngủ gà, từ nhẹ đến trung b́nh. Khi bệnh nhân ở t́nh trạng ngủ gà không nên lái xe, điều khiển máy móc.
QUÁ LIỀU
Không có thuốc giải độc đặc hiệu cho quá liều Gemtabicin HCl. Suy tủy, dị cảm và phát ban trầm trọng là các độc tính chủ yếu quan sát được khi dùng liều đơn cao tới 5,7 g/m2 bằng cách tiêm truyền tĩnh mạch trong 30 phút mỗi 2 tuần ở một số bệnh nhân trong một nghiên cứu pha 1. Trong trường hợp nghi ngờ quá liều, bệnh nhân phải được kiểm tra công thức máu một cách thích hợp và cần được điều trị hỗ trợ khi cần thiết.
BẢO QUẢN
Bảo quản trong bao b́ kín, Ở nhiệt độ 15 - 30 độ C.
HẠN DÙNG
24 tháng kể từ ngày sản xuất.
Không dùng thuốc quá hạn dùng ghi trên hộp.
TIÊU CHUẨN
USP 31.
ĐÓNG GÓI
1 Lọ/ Hộp.
Thuốc này chỉ dùng theo sự kê đơn của thầy thuốc.
Đọc kỹ hướng dẫn sử dụng trước khi dùng.
Nếu cần thêm thông tin, xin hỏi ư kiến bác sĩ. |